| |
| Med Sci (Paris). 2009 November; 25(11): 939–944. Published online 2009 November 15. doi: 10.1051/medsci/20092511939.Diffusion communautaire des entérobactéries sécrétrices de β-lactamase à spectre élargi (EBLSE) Jean-Ralph Zahar,2* Emmanuelle Bille,1 David Schnell,2 Fanny Lanternier,3 Frédéric Mechai,3 Virginie Masse,2 Xavier Nassif,1 and Olivier Lortholary3 1Université Paris Descartes, CHU Necker-Enfants-Malades, APHP, microbiologiehygiène hospitalière, 149, rue de Sèvres, 75743 Paris, France 2Université Paris Descartes, CHU Necker-Enfants-Malades, APHP, microbiologie hygiène hospitalière, Université Paris Descartes, CHU Necker-Enfants-Malades, APHP, équipe mobile d’infectiologie, 149, rue de Sèvres, 75743 Paris, France 3Université Paris Descartes, CHU Necker-Enfants-Malades, APHP, équipe mobile d’infectiologie, Université Paris Descartes, CHU Necker-Enfants-Malades, APHP, maladies infectieuses et tropicales, Centre d’infectiologie Necker-Pasteur, 149, rue de Sèvres, 75743 Paris, France |
Avant les années 2000, la lutte contre les bactéries multirésistantes (BMR) consistait en la maîtrise de la diffusion des Staphylococcus aureus résistants à la méticilline (SARM) au sein des établissements de santé et, dans les services à risque, des entérobactéries sécrétrices de β-lactamase à spectre élargi. Une politique volontariste de dépistage systématique des patients à risque de portage de SARM, de décontamination des porteurs et de maîtrise de la prescription antibiotique nous a permis de freiner la diffusion de cette bactérie et fait qu’aujourd’hui la France est l’un des seuls pays européens où l’incidence des SARM jusqu’alors particulièrement élevée est en diminution. Toutefois, alors que nos actions étaient essentiellement concentrées, en milieu hospitalier, sur la maîtrise du risque lié aux SARM, un nouveau risque se profile : celui de la diffusion des entérobactéries sécrétrices de β−lactamase à spectre élargi (EBLSE) hors de l’hôpital. La présence des EBLSE était essentiellement limitée aux hôpitaux et plus particulièrement aux unités de soins intensifs et aux services de gériatrie. Alors que la diffusion de ces bactéries se faisait sous un mode épidémique, nous assistons depuis les années 2000 à une diffusion de type endémique parmi les souches dites communautaires. Ce phénomène, par son mécanisme de résistance (plasmidique) et sa vitesse de diffusion, est un nouveau défi pour les infectiologues, les microbiologistes et les hygiénistes. En effet, chez les bactéries à Gram négatif, la production de β-lactamase, enzyme hydrolysant toutes les β-lactamines à l’exception des céphamycines (céfoxitine et céfotétan) et des carbapénèmes2, reste le mécanisme le plus fréquent de résistance aux β-lactamines [
1]. La présence de ce type de mécanisme de résistance au sein de souches pathogènes fait peser un risque majeur d’inadéquation thérapeutique et donc d’échec thérapeutique [
2], et est également un facteur de diffusion. La majeure partie des β-lactamases se répartit en trois groupes : les TEM, les SHV et les CTX-M [
3]. Au sein des entérobactéries, Klebsiella pneumoniae et Escherichia coli sont les deux espèces les plus fréquemment porteuses de ces mécanismes de résistance. Toutefois, ces enzymes ont été retrouvées au sein de nombreuses autres espèces bactériennes, entérobactéries et bacilles non fermentants (tels que Pseudomonas aeruginosa et Acinetobacter baumannii) [3]. |
Dès 1983 était rapportée la présence d’un plasmide de résistance au sein d’une souche de Klebsiella pneumoniae, codant pour une β-lactamase qui hydrolysait toutes les β-lactamines à l’exception des céphamycines et des carbapénèmes [
4]. Rapidement, d’autres β-lactamases ont été décrites (TEM, SHV, CTX-M), qui toutes ont la capacité d’hydrolyser l’ensemble des β-lactamines. Toutefois, jusqu’au début des années 2000, la majeure partie des enzymes décrites était isolée de souches d’entérobactéries colonisant ou infectant des patients hospitalisés et plus particulièrement en service de réanimation [
5]. Aujourd’hui, plus de cent EBLSE ont été décrites et leur épidémiologie a notablement changé. |
En effet, nous assistons à la diffusion d’un nouveau mécanisme de résistance lié à la diffusion des CTX-M. Il s’agit d’enzymes capables d’hydrolyser de façon prédominante, au sein des céphalosporines, le céfotaxime. Ainsi les concentrations minimales inhibitrices (CMI) de céfotaxime et de céfépime requises par les souches porteuses de ce mécanisme de résistance sont-elles supérieures à 64 µg/mL alors que les CMI de ceftazidime sont comprises entre 2 et 8 µg/mL. Toutefois, certaines CTX-M, à l’instar de CTX-M 15, hydrolysent la ceftazidime et les CMI atteignent 256 µg/mL. Il est à noter que ces enzymes n’ont aucune activité sur les céphamycines et les carbapénèmes. Elles sont par ailleurs inhibées par les inhibiteurs des β-lactamases comme le tazobactam, le sulbactam et, à un moindre degré, l’acide clavulanique. Cependant, les associations comprenant une β-lactamine et un inhibiteur des β-lactamases ne peuvent être utilisées en thérapeutique. En effet, les souches possédant une CTX-M sont fréquemment résistantes aux associations du fait de la présence associée dans leur génome d’un gène codant une pénicillinase de type OXA-1. Une même souche peut posséder deux enzymes différentes telles qu’une CTX-M et une SHV. D’autre part, un même plasmide de résistance possède de multiples gènes de résistance responsables d’une résistance croisée à de nombreux autres antibiotiques : aminoglycosides, les tétracyclines, le triméthoprime, le chloramphénicol et les sulfamides. Ainsi, dans une étude effectuée en Espagne, les pourcentages de résistance au sein de 285 souches d’EBLSE communautaires et de patients hospitalisés étaient de 27,4 % à la gentamicine et la tobramycine, 6,7 % à l’amikacine, 29,1 % au chloramphénicol, 61,7 % aux sulfamides, 52,3 % au triméthoprime et 37,2 % à la ciprofloxacine [
6]. De même, les auteurs d’une étude française menée au sein des établissements de l’Assistance publique-Hôpitaux de Paris (AP-HP) de 2003 à 2005 ont mis en évidence un pourcentage important de corésistance : 58 %, 76 %, 43,5 % et 67,5 % des souches étaient respectivement résistantes à la gentamicine, la tobramycine, l’amikacine et la ciprofloxacine [
7]. |
Avant les années 2000, la diffusion des EBLSE se faisait essentiellement en milieu hospitalier. En effet, de nombreuses épidémies hospitalières en réanimation [6] ou dans des établissements d’hospitalisation en longs séjours ont été décrites. Klebsiella pneumoniae était l’espèce la plus fréquemment rencontrée et TEM et SHV étaient les enzymes les plus souvent décrites. Depuis, les données épidémiologiques internationales et françaises soulignent l’augmentation de l’incidence des EBLSE en milieu hospitalier et de nombreuses publications font état d’infections communautaires. En effet, les données du réseau CCLIN Paris-Nord (Centre de coordination de la lutte contre les infections nosocomiales de l’inter-région Nord) révèlent des densités d’incidence de 0,21 cas pour 100 admissions [
8], chiffres en constante augmentation depuis quelques années alors même que la prévalence des Staphylococcus aureus résistants à la méticilline est en nette régression dans les hôpitaux français [
9]. Ce phénomène est mondial et concerne aussi bien le continent nord et sud-américain [
10] que l’Afrique, l’Asie [
11] et l’Europe [
12]. Ainsi, dans un travail réalisé à Barcelone entre 2001 et 2002, les auteurs ont noté une augmentation du pourcentage de patients non hospitalisés porteurs de EBLSE dans les selles : ce pourcentage atteignait 7,5 % des patients en 2002 mais seulement 2,1 % en 2001 [
13]. Une étude israélienne récente a mis en évidence que 13,7 % des souches d’entérobactéries isolées d’hémocultures prélevées au moment de l’admission des patients à l’hôpital possédaient une β-lactamase à spectre élargi. De même, 10,8 % des 241 patients dépistés étaient porteurs de EBLSE [
14]. Plus récemment, une étude réalisée en Arabie saoudite [
15] à partir de coprocultures a identifé un taux de portage d’EBLSE de 13,5 % chez les sujets sains et de 26,1 % chez les sujets hospitalisés. Dans les deux cas, Escherichia coli était l’espèce la plus fréquemment isolée. En France, une première étude épidémiologique effectuée en milieu urbain mais hors d’un contexte hospitalier de décembre 1996 à mars 1997 avait mis en évidence que 0,5 % des souches d’entérobactéries isolées d’examens cytobactériologiques des urines étaient sécrétrices de β-lactamase à spectre élargi [
16]. Plus récemment (en 2006), une étude prospective de deux mois menée en milieu communautaire en France, et dont l’objectif était d’étudier la prévalence des EBLSE isolées des examens cytobactériologiques des urines, chiffrait cette prévalence globale à 1,1 %. Dans ce travail, Escherichia coli était l’espèce la plus fréquemment isolée et CTX-M l’enzyme la plus fréquemment retrouvée [
17]. Enfin, pour résumer l’épidémiologie actuelle, alors que ce mécanisme de résistance concernait l’espèce Klebsiella pneumoniae, nous assistons depuis 2001 à une augmentation des cas au sein de l’espèce Escherichia coli liée essentiellement à la diffusion d’un même groupe d’enzymes : les CTX-M. En effet, alors qu’au sein des entérobactéries sécrétrices de β-lactamase à spectre élargi 40 % des souches de Klebsiella pneumoniae et 20 % des souches Escherichia coli étaient porteuses de EBLSE en 1997, les données de la collégiale de bactériologie de l’AP-HP mettent en évidence une augmentation du nombre d’isolats d’Escherichia coli sécréteurs de β-lactamase à spectre élargi. Actuellement, 50 % des souches d’entérobactéries sécrétrices de β-lactamase à spectre élargi sont des Escherichia coli et seulement 20 % des Klebsiella pneumoniae. De même, les données de l’AP-HP révélaient en 2005 que 78 % des 123 souches d’Escherichia coli BLSE isolées étaient porteuses d’une CTX-M de type CTX-M-15 dans 55 % des cas. 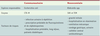 | Tableau I.
Principales caractéristiques des infections à EBLSE (adapté de [ 10]). |
|
La maîtrise de la diffusion des bactéries multirésistantes, et notamment des EBLSE, passe, à l’instar de la politique menée depuis dix ans contre les Staphylococcus aureus résistants à la méticilline, par l’identification des patients porteurs, la mise en place d’un isolement contact et la maîtrise de la prescription antibiotique. Pour les EBLSE, il nous semble important de définir le réservoir. Toutefois, si cela passe par la réalisation d’un dépistage systématique à l’admission, à ce jour il est difficile de définir la population cible. En effet, s’il nous paraît important de dépister les patients transférés de structures hospitalières et les anciens porteurs réadmis dans une structure hospitalière dans l’année qui suit la mise en évidence de leur portage, l’efficacité de cette pratique reste à démontrer. Ainsi, dans notre expérience personnelle, seuls 12 % des anciens porteurs étaient toujours colonisés un an après leur premier dépistage positif (données personnelles). De même, les services concernés par cette pratique restent à définir. En effet, si pour le SARM il s’agissait presque uniquement d’unités de soins intensifs, de services de longs séjours et de dermatologie, dans notre expérience des EBLSE le phénomène touche toutes les unités de notre établissement. Si les données cliniques qui décrivent les facteurs de risque d’acquisition d’EBLSE en milieu hospitalier abondent, plus rares sont les données épidémiologiques communautaires. En effet, les facteurs de risque identifiés en milieu hospitalier sont : la durée d’hospitalisation, l’utilisation de sondes gastriques, les gastrostomie ou jéjunostomie, une chirurgie récente, l’hémodialyse et les ulcères des membres inférieurs. L’antibiothérapie semble être un facteur de risque majeur. Nombreuses sont les classes d’antibiotiques dont l’utilisation a été associée à l’émergence d’entérobactéries sécrétrices de β-lactamase à spectre élargi. Les céphalosporines de troisième génération, les fluoroquinolones, le triméthoprime-sulfaméthoxazole, les aminoglycosides et le métronidazole ont ainsi été incriminés [6]. Quelques études récentes se sont intéressées aux facteurs de risque de portage ou d’infection communautaire. Une étude israélienne [
18], menée sur 311 patients dont 128 avaient une infection à EBLSE dite communautaire, a mis en évidence 10 facteurs associés au risque d’infection à EBLSE. Les facteurs isolés en analyse multivariée étaient : l’hospitalisation antérieure (dans les 3 mois précédant la mise en évidence de l’infection), un traitement antibiotique dans les 3 derniers mois, un âge supérieur à 60 ans, un diabète, le sexe masculin, une infection à Klebsiella pneumoniae.
Parmi les antibiotiques utilisés, les céphalosporines de deuxième et troisième générations, les fluoroquinolones et les pénicillines étaient associées à une augmentation significative du risque. Dans une étude cas-contrôle [
19] menée entre 2000 et 2004 en Espagne et évaluant les facteurs de risque d’infection communautaire urinaire à Escherichia coli BLSE, les auteurs ont mis en évidence une augmentation de la prévalence de 0,47 % à 1,7 % entre 2000 et 2004. Le seul facteur de risque associé à une infection communautaire était une prescription préalable de céphalosporines de seconde génération. Récemment, dans un travail mené en Israël, Ben Ami et ses collaborateurs [14] ont identifié deux facteurs associés aux bactériémies à EBLSE survenant dans les 48 premières heures d’hospitalisation : le sexe masculin et le transfert à partir d’une structure hospitalière de long séjour. Dans ce même travail, 5 facteurs étaient associés au portage d’EBLSE : une antibiothérapie en cours, l’utilisation de médicaments anti-histamine de type 2, une hépatopathie, une insuffisance rénale chronique et un état général altéré. Dans une étude cas-contrôle effectuée sur une durée de quatre ans à Séville, Rodriguez-Bano et ses collaborateurs [
20] ont montré que le diabète, l’utilisation préalable de fluoroquinolones, de céphalosporines de troisième génération, une maladie rapidement évolutive et la présence d’un sondage urinaire étaient les facteurs de risque indépendants associés aux infections communautaires à E. coli sécréteur de β-lactamase à spectre élargi de type CTX-M. Les mêmes auteurs [
21], dans une étude cas-contrôle comparant 43 cas de bactériémies à E. coli BLSE (dont 70 % possédaient une enzyme de type CTX-M) à 86 cas de bactériémies à E. coli non sécréteurs de BLSE, identifient trois facteurs de risque associés aux infections à E. coli BLSE : le sondage urinaire, l’utilisation de céphalosporines ou de fluoroquinolones. Dans un travail plus récent de Harris et ses collaborateurs [
22], incluant une cohorte de patients admis en réanimation à l’hôpital de l’université du Maryland entre septembre 2001 et juin 2005, 4 facteurs de risque associés au portage d’EBLSE ont été mis en évidence en analyse multivariée : une prescription préalable de pipéracilline-tazobactam, de vancomycine, un âge supérieur à 60 ans et une maladie chronique. Finalement, dans un travail récent effectué par Lavigne et ses collaborateurs [
23], 4 facteurs de risque étaient associés à l’acquisition d’un E. coli avec une CTX-M : l’infection urinaire, la présence d’un sondage urinaire, un diabète et une insuffisance rénale. Plus récemment, une étude de portage dans l’environnement proche de patients porteurs mettait en évidence un taux de portage de 16,5 % chez les personnes ayant été en contact avec les patients [
24]. Enfin, une étude canadienne retrouvait chez les patients ayant une infection communautaire par E. coli BLSE 8 facteurs de risque : l’hémodialyse, l’incontinence urinaire, un cancer, une insuffisance rénale, un diabète et un voyage récent en Inde, en Afrique ou au Moyen-Orient [
25]. |
La maîtrise du risque de diffusion des bactéries multirésistantes en milieu hospitalier repose sur la théorie du « search and destroy ». En effet, en France, la diminution de l’incidence des infections à SARM a été obtenue grâce aux différentes campagnes de promotion de l’hygiène des mains, à l’introduction des solutions hydroalcooliques, aux actions de dépistage et de décolonisation menées et à l’isolement des patients porteurs/infectés dans les services à risque. Dans le cas du SARM, seul le dépistage permet d’identifier le réservoir bactérien [23,
26], mais il n’est pas certain que l’on puisse mettre en œuvre cette même politique agressive de lutte pour les EBLSE. En effet, le réservoir potentiel est bien plus important (nous sommes tous porteurs d’entérobactéries et d’Escherichia coli !), la difficulté à définir les patients potentiellement porteurs ou infectés, la rapidité de dissémination du phénomène et les conséquences économiques et individuelles de la mise en place de l’isolement contact3 justifient ces interrogations. De plus, si le risque de portage au sein d’une même famille est maintenant démontré, la survenue d’une épidémie hospitalière à E. coli sécréteurs de BLSE quoique très probable, est rarement décrite. Toutefois, il est important, vu l’ampleur du phénomène et les risques épidémiques, de souligner l’importance de maintenir une politique hospitalière d’isolement de type contact chez les patients infectés ou colonisés. En effet, les données épidémiologiques actuelles montrant la diffusion des EBLSE et l’augmentation des taux d’incidence dans les établissements de santé justifient le maintien à ce jour des recommandations d’isolement des patients dans les services hospitaliers « aigus » quels que soient l’espèce isolée et le type de service concerné. Dans les services de soins de suite et de réadaptation, la priorité doit être donnée à la réinsertion du patient dans son milieu. Dans ce contexte, chez les patients continents et à condition d’une hygiène corporelle acceptable, le maintien de l’isolement ne semble pas justifié. Aucune mesure particulière ne doit être proposée aux patients à domicile. Toutefois, le statut de porteur doit être communiqué aux différents acteurs de soins, notamment en cas d’hospitalisation ou de soins médicaux à domicile.  | Tableau II.
Propositions pour contrôler la diffusion des EBLSE.
|
|
Si la connaissance des facteurs de risque de portage ou d’infection permet l’identification d’un patient potentiellement porteur de BLSE, le choix de l’antibiothérapie probabiliste (voir note 1) reste lui très difficile du fait de la résistance des souches aux différentes β-lactamines et de la fréquence des corésistances. Par ailleurs, la diffusion variable des antibiotiques, notamment dans les urines, rend le choix thérapeutique difficile en cas d’infections urinaires. Il est important de noter que l’épidémiologie de la résistance bactérienne en France ne justifie pas à ce jour la modification de nos pratiques. Toutefois, rares sont les classes antibiotiques thérapeutiques encore disponibles pour traiter des infections à EBLSE. Parmi elles, la céfoxitine (Méfoxin®) avec le risque de résistance secondaire par imperméabilité, la temocilline (Negaban®) qui, dans certaines études, notamment en Belgique, garde une efficacité sur 91,9 % des souches étudiées [
27–
28], le pivmecillinam, prodrogue du mecillinam, utilisé dans les infections urinaires basses dans le nord de l’Europe [
29]. Dans notre expérience, à l’hôpital Necker-Enfants Malades, 86 % des souches restent sensibles in vitro à la tigécycline (Tygacil®). La fosfomycine ainsi que la nitrofurantoïne peuvent être utilisées en cas de cystite. Dans notre expérience, 76 %, 95 % et 96 % des souches d’E. coli BLSE isolées entre 2000 et 2007 étaient respectivement sensibles à la céfoxitine, la fosfomycine et la nitrofurantoïne. Il est important de noter que seuls les carbapénèmes restent constamment actives sur les souches d’EBLSE, parmi elles le méropénème, l’imipénème et l’ertapénème. Le spectre antibactérien des carbapénèmes est pratiquement le même pour toutes les molécules à l’exception de l’ertapénème qui n’a qu’une activité marginale sur P. aeruginosa et A. baumannii. Toutefois, les CMI vis-à-vis des entérobactéries sont plus élevées pour l’imipénème que pour les deux autres molécules. Enfin, si les principales caractéristiques pharmacocinétiques des trois molécules sont superposables, la demi-vie de l’ertapénème est quatre fois plus longue que celle des autres molécules, ce qui autorise une administration unique journalière. |
La diffusion communautaire des EBLSE est d’ores et déjà une préoccupation majeure. Elle concerne majoritairement E. coli et l’enzyme la plus répandue est une CTX-M. La maîtrise du risque repose sur une attitude pragmatique qui permet d’identifier les porteurs et d’éviter la transmission croisée par le respect des mesures d’hygiène. Du fait de la fréquence des corésistances, seuls les carbapénèmes restent constamment actives. L’épidémiologie française ne justifie pas à ce jour de modifier nos pratiques antibiotiques probabilistes. Toutefois, il est important que tous les cliniciens soient vigilants quant aux facteurs de risque de portage ou d’infection afin d’éviter des retards thérapeutiques responsables d’une prolongation des durées de séjour et d’une probable surmortalité. Il est urgent de définir une politique globale de maîtrise du risque et des situations à risque nécessitant de modifier nos choix antibiotiques probabilistes [29]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Livermore DM. Bacterial resistance: origins, epidemiology, and impact. Clin Infect Dis 2003; 36 (suppl 1) : S11–23. 2. Schwaber MJ, Carmeli Y. Mortality and delay in effective therapy associated with extended-spectrum beta-lactamase production in Enterobacteriaceae bacteraemia: a systematic review and meta-analysis. J Antimicrob Chemother 2007; 60 : 913–20. 3. Jacoby GA, Munoz-Price LS. The new beta-lactamases. N Engl J Med 2005; 352 : 380–91. 4. Knothe H, Shah P, Krcmery V, et al. Transferable resistance to cefotaxime, cefoxitin, cefamandole and cefuroxime in clinical isolates of Klebsiella pneumoniae and Serratia marcescens. Infection 1983; 11 : 315–7. 5. Lucet JC, Decré D, Fichelle A, et al. Control of a prolonged outbreak of extended-spectrum beta-lactamase-producing enterobacteriaceae in a university hospital. Clin Infect Dis 1999; 29 : 1411–8. 6. Paterson DL, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev 2005; 18 : 657–86. 7. Nicolas-Chanoine MH, Jarlier V, et al. Extended-spectrum beta-lactamases in long-term-care facilities. Clin Microbiol Infect 2008; 14 (suppl 1) : 111–6. 9. Lucet JC, Paoletti X, Lolom I, et al. Successful long-term program for controlling methicillin-resistant Staphylococcus aureus in intensive care units. Intensive Care Med 2005; 31 : 1051–7. 10. Pitout JD, Laupland KB. Extended-spectrum beta-lactamase-producing Enterobacteriaceae: an emerging public-health concern. Lancet Infect Dis 2008; 8 : 159–66. 11. Hawkey PM. Prevalence and clonality of extended-spectrum beta-lactamases in Asia. Clin Microbiol Infect 2008; 14 (suppl 1) : 159–65. 12. Livermore DM, Canton R, Gniadkowski M, et al. CTX-M: changing the face of ESBL in Europe. J Antimicrob Chemother 2007; 59 : 165–74. 13. Valverde A, Coque TM, Sánchez-Moreno MP, et al. Dramatic increase in prevalence of fecal carriage of extended-spectrum beta-lactamase-producing Enterobacteriaceae during nonoutbreak situations in Spain. J Clin Microbiol 2004; 42 : 4769–75. 14. Ben-Ami R, Schwaber MJ, Navon-Venezia S, et al. Influx of extended-spectrum beta-lactamase-producing enterobacteriaceae into the hospital. Clin Infect Dis 2006; 42 : 925–34. 15. Kader AA, Kumar A, Kamath KA. Fecal carriage of extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae in patients and asymptomatic healthy individuals. Infect Control Hosp Epidemiol 2007; 28 : 1114–6. 16. Goldstein FW. Antibiotic susceptibility of bacterial strains isolated from patients with community-acquired urinary tract infections in France. Multicentre Study Group. Eur J Clin Microbiol Infect Dis 2000; 19 : 112–7. 17. Grobost F. Épidémiologie des entérobactéries productrices deβ-lactamase à spectre élargi (EBLSE communautaires en France : enquête transréseaux dans les laboratoires de ville). Paris, France : 26e RICAI, réunion interdisciplinaire de chimiothérapie anti-infectieuse, 2006 (abstract). 18. Colodner R, Rock W, Chazan B, et al. Risk factors for the development of extended-spectrum beta-lactamase-producing bacteria in nonhospitalized patients. Eur J Clin Microbiol Infect Dis 2004; 23 : 163–7. 19. Calbo E, Romaní V, Xercavins M, et al. Risk factors for community-onset urinary tract infections due to Escherichia coli harbouring extended-spectrum beta-lactamases. J Antimicrob Chemother 2006; 57 : 780–3. 20. Rodríguez-Baño J, Navarro MD, Romero L, et al. Clinical and molecular epidemiology of extended-spectrum beta-lactamase-producing Escherichia coli as a cause of nosocomial infection or colonization: implications for control. Clin Infect Dis 2006; 42 : 37–45. 21. Rodríguez-Baño J, Navarro MD, Romero L, et al. Risk-factors for emerging bloodstream infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Clin Microbiol Infect 2008; 14 : 180–3. 22. Harris AD, McGregor JC, Johnson JA, et al. Risk factors for colonization with extended-spectrum beta-lactamase-producing bacteria and intensive care unit admission. Emerg Infect Dis 2007; 13 : 1144–9. 23. Lavigne JP, Marchandin H, Delmas J, et al. CTX-M beta-lactamase-producing Escherichia coli in French hospitals: prevalence, molecular epidemiology, and risk factors. J Clin Microbiol 2007; 45 : 620–6. 24. Valverde A, Grill F, Coque TM, et al. High rate of intestinal colonization with extended-spectrum-beta-lactamase-producing organisms in household contacts of infected community patients. J Clin Microbiol 2008; 46 : 2796–9. 25. Laupland KB, Church DL, Vidakovich J, et al. Community-onset extended-spectrum beta-lactamase (ESBL) producing Escherichia coli: importance of international travel. J Infect 2008; 57 : 441–8. 26. Reddy P, Malczynski M, Obias A, et al. Screening for extended-spectrum beta-lactamase-producing Enterobacteriaceae among high-risk patients and rates of subsequent bacteremia. Clin Infect Dis 2007; 45 : 846–52. 27. Glupczynski Y, Huang TD, Berhin C, et al. In vitro activity of temocillin against prevalent extended-spectrum beta-lactamases producing enterobacteriaceae from Belgian intensive care units. Eur J Clin Microbiol Infect Dis 2007; 26 : 777–83. 28. Livermore DM, Tulkens PM. Temocillin revived. J Antimicrob Chemother 2009; 63 : 243–5. 29. Thomas K, Weinbren MJ, Warner M, et al. Activity of mecillinam against ESBL producers in vitro. J Antimicrob Chemother 2006; 57 : 367–8. 30. Zahar JR, Lortholary O, Martin C, et al. Addressing the challenge of extended-spectrum beta-lactamases. Curr Opin Investig Drugs 2009; 10 : 172–80. |



